Indhold
Den procentvise masse bestemmer procentdelen af hvert element, der danner en kemisk forbindelse. For at finde denne værdi skal du bruge molmassen af de sammensatte grundstoffer i gram / mol eller det antal gram, der bruges til at skabe løsningen. Den procentvise masse kan beregnes på en enkel måde ved hjælp af en grundformel, der deler massen af elementet (eller opløst stof) med massen af forbindelsen (eller opløsningen).
Trin
Metode 1 af 2: Find den procentvise masse med givne masser
- Definer ligningen for den procentvise masse af en forbindelse. Grundformlen for en forbindelse er: procentmasse = () x 100. Du skal gange resultatet med 100 i slutningen for at udtrykke værdierne i procent.
- Massen af en kemisk forbindelse, som du er interesseret i, er den masse, der er angivet i problemet. Hvis denne værdi ikke er angivet, henvises til følgende metode og lærer, hvordan man finder den procentvise masse, når massen ikke er givet.
- Den samlede masse af en forbindelse beregnes ved at tilføje masserne af alle de elementer, der bruges til at danne forbindelsen eller opløsningen.
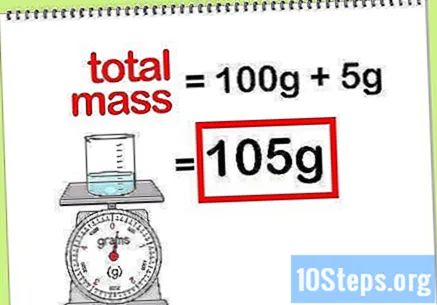
Beregn den samlede masse af forbindelsen. Når du kender masseværdien af alle de grundstoffer eller forbindelser, der tilsættes, skal du blot tilføje dem for at beregne massen af forbindelsen eller den endelige opløsning. Denne værdi vil være nævneren ved beregningen af den procentvise masse.- For eksempel: Hvad er den procentvise masse af 5 g natriumhydroxid opløst i 100 g vand?
- Den samlede masse af forbindelsen er mængden af natriumperoxid plus mængden af vand: 100 g + 5 g, i alt en masse på 105 g.

Identificer massen af det pågældende kemikalie. Når du har brug for at finde procent masse, ønsker problemet, at du finder massen af et bestemt element (det pågældende element) som en procentdel af den samlede masse af alle elementer. Bemærk massen af det pågældende element. Denne værdi vil være tælleren i beregningen af den procentvise masse.- For eksempel er elementets masse 5 g natriumhydroxid.
- Erstat variablerne i den procentvise masseformel. Efter at have bestemt værdierne for hver variabel, skal du udskifte dem i ligningen.
- For eksempel: procentmasse = () x 100 = () x 100.

Beregn den procentvise masse. Nu hvor ligningen er dannet, skal du bare løse den for at beregne den procentvise masse. Del massen af elementet med den samlede masse af forbindelsen og gang med 100. Resultatet vil være den procentvise masse af det kemiske element.- For eksempel: () x 100 = 0,04761 x 100 = 4,751%. Således er den procentvise masse af 5 g natriumhydroxid opløst i 100 g vand 4,751%.
Metode 2 af 2: Find den procentvise masse med ikke angivet masse
- Definer ligningen for den procentvise masse af en forbindelse. Grundformlen for den procentvise masse af en forbindelse er: procent masse = () x 100. Du skal gange resultatet med 100 i slutningen for at udtrykke værdierne som procentdele.
- Når du ikke kender masseværdierne, kan du finde den procentvise masse af et element af forbindelsen ved hjælp af den molære masse.
- For eksempel: Hvad er den procentvise masse af brint i et vandmolekyle?.
Skriv kemisk formel. Hvis de kemiske formler for hver forbindelse ikke er angivet, skal du skrive dem ned. Ellers spring til trin "Find massen af hvert element".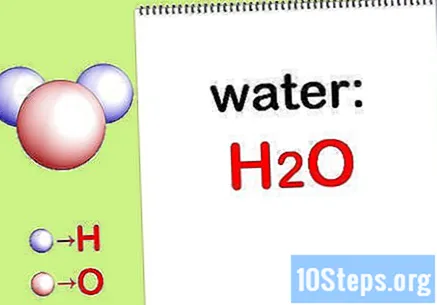
- Skriv f.eks. Den kemiske formel for vand: H2DET.
Find massen af hvert element i forbindelsen. Se efter molekylvægten for hvert element i de kemiske formler ved at henvise til det periodiske system. Generelt kan massen af et element findes under det kemiske grundstofsymbol. Bemærk masserne af hvert element af forbindelsen.
- For eksempel er iltets molekylvægt 15.9994, og den for hydrogen er 1.0079.
Multiplicer masserne med molforholdet. Identificer hvor mange mol af hvert grundstof der er i den kemiske forbindelse. Antallet af mol er angivet med det abonnerede nummer på forbindelsen. Multiplicer molekylvægten for hvert element med molforholdet.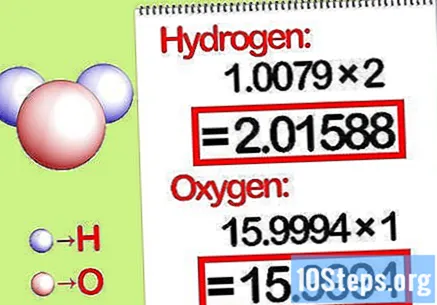
- For eksempel er molforholdet mellem brint og ilt i vand 2: 1. Multiplicer derfor molekylvægten af hydrogen med to (1,00794 X 2 = 2,01588), og lad iltets molekylvægt være som den er (15.9994).
Beregn den samlede masse af forbindelsen. Tilføj den samlede masse af alle elementerne i forbindelsen. Ved hjælp af masserne beregnet af molforholdet er det muligt at beregne den samlede masse af forbindelsen. Dette tal vil være nævneren for den procentvise masseligning.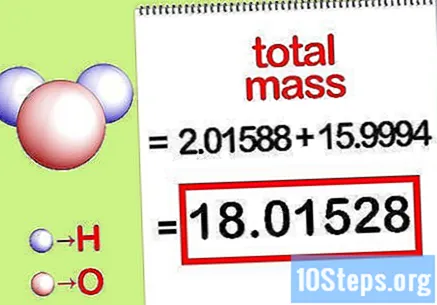
- For eksempel tilsættes 2,01588 g / mol (massen af to mol hydrogenatomer) med 15,9994 g / mol (massen af en enkelt mol af et oxygenatom) og får 18,01528 g / mol.
Identificer massen af det pågældende element. Når du har brug for at finde procent masse, ønsker problemet, at du finder massen af et bestemt element i en forbindelse som en procentdel af den samlede masse af alle elementer. Identificer massen af det pågældende element, og skriv det ned. Det er masseværdien beregnet ved hjælp af molforholdet. Denne værdi er tælleren for den procentvise masseligning.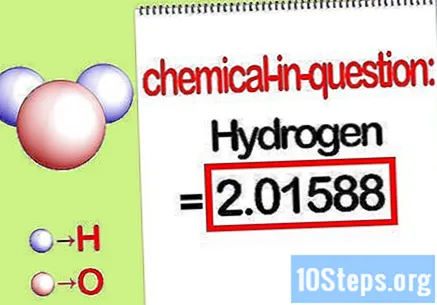
- For eksempel er hydrogenmassen af forbindelsen 2,01588 g / mol (massen af to mol hydrogenatomer).
- Erstat variablerne i den procentvise masseformel. Efter at have bestemt værdierne for hver variabel, skal du erstatte dem i ligningen defineret i det første trin: procentmasse = () x 100.
- For eksempel: procentmasse = () x 100 = () x 100.
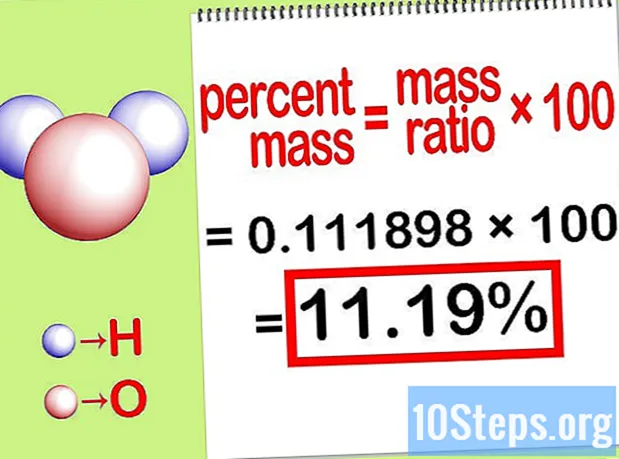
Beregn den procentvise masse. Nu hvor ligningen er dannet, skal du bare løse den for at beregne den procentvise masse. Del massen af elementet med den samlede masse af forbindelsen og gang med 100. Resultatet vil være den procentvise masse af det kemiske element.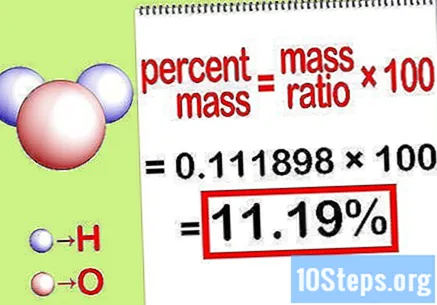
- F.eks. Procentmasse = () x 100 = 0,1111189 x 100 = 11,18%. Således er den procentvise masse af hydrogenatomer i et vandmolekyle 11,18%.