Forfatter:
Mike Robinson
Oprettelsesdato:
7 September 2021
Opdateringsdato:
11 Kan 2024
Indhold
Atomtallet svarer til antallet af protoner i kernen af et enkelt atom i et element. Denne værdi ændres ikke; derfor kan du bruge den til at opdage andre egenskaber ved isotopen, såsom antallet af neutroner.
Trin
Del 1 af 2: Find atomnummeret
Find en kopi af det periodiske system. Klik her, hvis du ikke har en tilgængelig. Hvert element har sit eget atomnummer; der er således ingen genveje til at lære indholdet. Brug en kopi af tabellen, eller prøv at huske den.
- I de fleste kemibøger er bordet trykt på bagsiden.

Find det element, du studerer i tabellen. De fleste tabeller inkluderer elementernes fulde navn samt deres symboler (f.eks. Hg for kviksølv). Hvis du ikke kan finde det, du leder efter, skal du gå online og foretage en søgning med ordene "kemisk symbol" og navnet på elementet.
Find elementets atomnummer. Det er normalt i øverste venstre eller højre hjørne af elementets hus, men det kan også komme andre steder. Derudover er det altid et heltal.- Hvis tallet inkluderer et decimaltegn, angiver det sandsynligvis atommassen.
Bekræft oplysningerne i henhold til elementerne i nærheden. Det periodiske system er organiseret efter rækkefølgen af atomnumre. Hvis dit isotopnummer f.eks. Er "33", er elementet til venstre "32" og det til højre "34". I så fald er det fordi du kigger på atomnummeret.
- Der er et spring mellem elementerne "56" (barium) og "88" (radio). De isotoper, der svarer til dette interval, er i de to rækker under tabellen. De adskilles kun sådan, så bordet ikke er for stort.

Forstå hvad atomnummeret betyder. Atomtallet har en enkel definition: mængden af protoner i et atom af elementet. Denne mængde protoner bestemmer igen kernens samlede elektriske ladning - hvilket følgelig bestemmer, hvor mange elektroner atomet kan oplade. Da elektroner er ansvarlige for næsten alle kemiske interaktioner, påvirker atomnummeret indirekte elementets fysiske og kemiske egenskaber.- Med andre ord svarer hvert atom med otte protoner til et oxygenatom. To iltatomer kan have forskellige antal neutroner eller (hvis man er en ion) eller elektroner, men de vil altid have otte protoner hver.
Del 2 af 2: Opdag vigtigere information
Bestem atomvægten. Det kommer normalt under navnet på elementet i det periodiske system og har to eller tre decimaler. Atomvægt svarer til den gennemsnitlige masse af et grundstofs atomer, der repræsenterer hvordan det findes i naturen. Det måles i "atommasseenheder" ("u" eller "u.m.a").
- Mange forskere foretrækker at bruge udtrykket "atommasse" i stedet for vægt.
Forstå atommasse. Begrebet atommasse svarer meget til vægten. Forskellen er, at vægten angiver den gennemsnitlige masse af ethvert atom i elementet, ikke et specifikt atom. For eksempel: et gram jern indeholder flere atomer med forskellige masser; vægten angiver deres "relative masse". Hvis du studerer et enkelt atom af elementet, skal du bare kende dets specifikke masse.
- Generelt informerer kemiproblemer, der kun involverer atomer, allerede atommassetallet. Du skal bare forstå konceptet for ikke at blive fanget af vagt, når du ser en anden værdi.
Rund massetallet. Massetallet svarer til den samlede mængde protoner og neutroner i elementets atom. Det er ikke svært at beregne det: Bare tag den atomare masse, der er trykt på det periodiske system, og rund den til nærmeste helhedsværdi.
- Dette virker, fordi mængderne af neutroner og protoner er meget tæt på 1 u.m.a., mens mængden af elektroner er meget tæt på nul. Atommasse involverer nøjagtige beregninger for at bestemme decimalværdien, men de eneste data, der betyder noget, er hele tal, som fortæller dig, hvor mange protoner og neutroner der er.
- Husk, at hvis du bruger atommasse, vil du rod med vægten af et bestemt atom i et element. En bromprøve har for eksempel en atommasse på 79 eller 81.
Beregn antallet af neutroner. Nu ved du allerede, at atomnummeret er lig med antallet af protoner, og at massetallet er lig med summen af antallet af protoner og neutroner. For at bestemme mængden af neutroner i et element skal du blot trække atomnummeret fra den samlede masse. Nogle eksempler:
- Et heliumatom (He) har et massetal på 4 og et atomnummer på 2. Derfor er 4 - 2 = 2 neutroner.
- En prøve af sølv (Ag) har et gennemsnitligt massetal på 108 (ifølge det periodiske system) og et atomnummer på 47. I gennemsnit har hvert atom i prøven 108 - 47 = 61 neutroner.
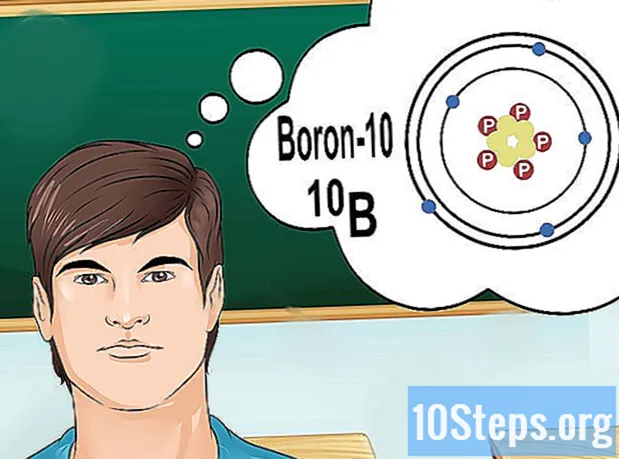
Forstå isotoper. En isotop er en bestemt form for et element, der indeholder et antal neutroner. Hvis det problem, du vil løse, bringer noget som "bor-10" eller "B", er det fordi du taler om elementerne i bor med massetallet på 10. Brug denne værdi, ikke de "normale" værdier af bor.
- Atomantal isotoper ændres aldrig. Hver isotop af et element har det samme antal protoner.
Tips
- Atomvægten for nogle tungere elementer kommer i parentes eller firkantede parenteser. Dette betyder, at denne vægt er den nøjagtige masse af den mest stabile isotop, ikke et gennemsnit på flere isotoper. Endelig påvirker dette ikke elementets atomnummer.


