Indhold
Andre sektionerInden for kemi, valenselektroner er de elektroner, der er placeret i et elements yderste elektronskal. At vide, hvordan man finder antallet af valenselektroner i et bestemt atom, er en vigtig færdighed for kemikere, fordi denne information bestemmer, hvilke typer kemiske bindinger, den kan danne, og derfor elementets reaktivitet. Heldigvis er alt hvad du behøver for at finde et elements valenselektroner en standard periodisk tabel over elementerne.
Trin
Del 1 af 2: Find valenselektroner med et periodisk system
Ikke-overgangsmetaller
Find en periodisk system af elementer. Dette er et farvekodet bord bestående af mange forskellige firkanter, der viser alle de kemiske grundstoffer, som mennesket kender. Det periodiske system afslører masser af information om elementerne - vi bruger nogle af disse oplysninger til at bestemme antallet af valenselektroner i det atom, vi undersøger. Du kan normalt finde disse inde i omslaget til kemibøger. Der er også et fremragende interaktivt bord tilgængeligt online her.

Mærk hver kolonne i det periodiske system med elementer fra 1 til 18. Generelt på et periodisk system vil alle elementerne i en enkelt lodret søjle have det samme antal valenselektroner. Hvis din periodiske tabel ikke allerede har hver kolonne nummereret, skal du give hver et tal, der starter med 1 for den yderste venstre ende og 18 for den yderste højre ende. I videnskabelige termer kaldes disse kolonner elementet "grupper."- For eksempel, hvis vi arbejdede med et periodisk system, hvor grupperne ikke er nummererede, ville vi skrive en 1 over hydrogen (H), en 2 over Beryllium (Be) og så videre, indtil vi skrev en 18 over Helium (He) .

Find dit element på bordet. Find nu det element, som du vil finde valenselektronerne til på bordet. Du kan gøre dette med dets kemiske symbol (bogstaverne i hver boks), dets atomnummer (tallet øverst til venstre i hver boks) eller en hvilken som helst af de andre informationer, der er tilgængelige på bordet.- Lad os f.eks. Finde valenselektronerne til et meget almindeligt element: kulstof (C). Dette element har et atomnummer på 6. Det er placeret øverst i gruppe 14. I det næste trin finder vi dets valenselektroner.
- I dette underafsnit vil vi ignorere de overgangsmetaller, som er elementerne i den rektangelformede blok lavet af gruppe 3 til 12. Disse elementer er lidt forskellige fra resten, så trinnene i dette underafsnit vandt ' t arbejde på dem. Se hvordan man håndterer disse i underafsnittet nedenfor.

Brug gruppetallene til at bestemme antallet af valenselektroner. Gruppetallet på et ikke-overgangsmetal kan bruges til at finde antallet af valenselektroner i et atom af dette element. Det et sted for gruppenummeret er antallet af valenselektroner i et atom af disse grundstoffer. Med andre ord:- Gruppe 1: 1 valenselektron
- Gruppe 2: 2 valenselektroner
- Gruppe 13: 3 valenselektroner
- Gruppe 14: 4 valenselektroner
- Gruppe 15: 5 valenselektroner
- Gruppe 16: 6 valenselektroner
- Gruppe 17: 7 valenselektroner
- Gruppe 18: 8 valenselektroner (undtagen helium, som har 2)
- I vores eksempel, da kul er i gruppe 14, kan vi sige, at et atom af kul har fire valenselektroner.
Overgangsmetaller
Find et element fra gruppe 3 til 12. Som nævnt ovenfor kaldes elementerne i gruppe 3 til 12 "overgangsmetaller" og opfører sig anderledes end resten af elementerne, når det kommer til valenselektroner. I dette afsnit forklarer vi, hvordan det til en vis grad ofte ikke er muligt at tildele valenselektroner til disse atomer.
- Lad os f.eks. Vælge Tantal (Ta), element 73. I de næste par trin finder vi dets valenselektroner (eller i det mindste prøve til.)
- Bemærk, at overgangsmetalerne inkluderer lanthanid- og actinidserien (også kaldet "sjældne jordmetaller") - de to rækker af elementer, der normalt er placeret under resten af tabellen, der starter med lanthan og actinium. Disse elementer tilhører alle gruppe 3 i det periodiske system.
Forstå, at overgangsmetaller ikke har "traditionelle" valenselektroner. At forstå, hvorfor overgangsmetaller ikke rigtig "fungerer" som resten af det periodiske system, kræver en lille forklaring på, hvordan elektroner opfører sig i atomer. Se nedenfor for en hurtig gennemgang, eller spring dette trin over for at komme direkte til svarene.
- Når elektroner føjes til et atom, sorteres de i forskellige "orbitaler" - grundlæggende forskellige områder omkring kernen, som elektronerne samles i. Generelt er valenselektronerne elektronerne i den yderste skal - med andre ord de sidste elektroner, der er tilføjet .
- Af grunde, der er lidt for komplekse til at forklare her, når elektroner føjes til det yderste d skal af et overgangsmetal (mere om dette nedenfor), de første elektroner, der går ind i skallen, har tendens til at virke som normale valenselektroner, men efter det fungerer de ikke, og elektroner fra andre orbitallag fungerer undertiden som valenselektroner i stedet. Dette betyder, at et atom kan have flere antal valenselektroner afhængigt af hvordan det manipuleres.
Bestem antallet af valenselektroner baseret på gruppenummeret. Igen kan gruppenummeret for det element, du undersøger, fortælle dig dets valenselektroner. For overgangsmetaller er der imidlertid ikke et mønster, du kan følge - gruppenummer svarer normalt til en række mulige antal valenselektroner. Disse er:
- Gruppe 3: 3 valenselektroner
- Gruppe 4: 2 til 4 valenselektroner
- Gruppe 5: 2 til 5 valenselektroner
- Gruppe 6: 2 til 6 valenselektroner
- Gruppe 7: 2 til 7 valenselektroner
- Gruppe 8: 2 eller 3 valenselektroner
- Gruppe 9: 2 eller 3 valenselektroner
- Gruppe 10: 2 eller 3 valenselektroner
- Gruppe 11: 1 eller 2 valenselektroner
- Gruppe 12: 2 valenselektroner
- I vores eksempel, da Tantal er i gruppe 5, kan vi sige, at det har mellem to og fem valenselektronerafhængigt af situationen.
Del 2 af 2: Find valenselektroner med en elektronkonfiguration
Lær hvordan du læser en elektronkonfiguration. En anden måde at finde elementets valenselektroner er med noget, der kaldes en elektronkonfiguration. Disse kan i første omgang se komplicerede ud, men de er bare en måde at repræsentere elektronorbitalerne i et atom med bogstaver og tal, og de er lette, når du ved, hvad du ser på.
- Lad os se på en eksempelkonfiguration for elementet natrium (Na):
- 1s2s2p3s
- Bemærk, at denne elektronkonfiguration bare er en gentagende streng, der går sådan her:
- (nummer) (bogstav) (nummer) (bogstav) ...
- ...og så videre. Det (nummer) (bogstav) klump er navnet på elektronbanen og er antallet af elektroner i den orbitale - det er det!
- Så for vores eksempel vil vi sige, at natrium har 2 elektroner i 1'ers orbital plus 2 elektroner i 2'ers orbital plus 6 elektroner i 2p orbitalen plus 1 elektron i 3'ers orbital. Det er 11 elektroner i alt - natrium er element nummer 11, så det giver mening.
- Husk, at hver subshell har en vis elektronkapacitet. Deres elektronkapacitet er som følger:
- s: 2 elektronkapacitet
- p: 6 elektronkapacitet
- d: 10 elektronkapacitet
- f: 14 elektronkapacitet
- Lad os se på en eksempelkonfiguration for elementet natrium (Na):
Find elektronkonfigurationen til det element, du undersøger. Når du kender et elements elektronkonfiguration, er det ret simpelt at finde dets antal valenselektroner (undtagen selvfølgelig for overgangsmetaller.) Hvis du får konfigurationen fra starten, kan du springe til næste trin. Hvis du skal finde det selv, se nedenfor:
- Undersøg komplet elektronkonfiguration for oganesson (Og), element 118, som er det sidste element i det periodiske system. Det har flest elektroner af ethvert element, så dets elektronkonfiguration viser alle de muligheder, du kan støde på i andre elementer:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Nu hvor du har dette, er alt hvad du skal gøre for at finde et andet atoms elektronkonfiguration, bare at udfylde dette mønster fra starten, indtil du løber tør for elektroner. Dette er lettere, end det lyder. For eksempel, hvis vi vil lave kredsløbsdiagrammet for klor (Cl), element 17, som har 17 elektroner, ville vi gøre det sådan:
- 1s2s2p3s3p
- Bemærk, at antallet af elektroner tilføjes til 17: 2 + 2 + 6 + 2 + 5 = 17. Du behøver kun at ændre antallet i den sidste orbital - resten er den samme, da orbitalerne før den sidste er helt fulde .
- For mere om elektronkonfigurationer, se også denne artikel.
- Undersøg komplet elektronkonfiguration for oganesson (Og), element 118, som er det sidste element i det periodiske system. Det har flest elektroner af ethvert element, så dets elektronkonfiguration viser alle de muligheder, du kan støde på i andre elementer:
Tildel elektroner til orbitalskaller med oktetreglen. Når elektroner føjes til et atom, falder de i forskellige orbitaler i overensstemmelse med rækkefølgen ovenfor - de første to går ind i 1s orbitalen, de to derefter går ind i 2s orbitalen, de seks derefter går ind i 2p orbitalen, og snart. Når vi har at gøre med atomer uden for overgangsmetallerne, siger vi, at disse orbitaler danner "orbitalskaller" omkring kernen, idet hver på hinanden følgende skal er længere ude end dem, der var før. Udover den allerførste skal, der kun kan rumme to elektroner, kan hver skal have otte elektroner (undtagen igen når det drejer sig om overgangsmetaller.) Dette kaldes Oktetregel.
- Lad os for eksempel sige, at vi ser på elementet Bor (B). Da atomnummeret er fem, ved vi, at det har fem elektroner, og dets elektronkonfiguration ser sådan ud: 1s2s2p. Da den første orbitalskal kun har to elektroner, ved vi, at Bor har to skaller: en med to 1s elektroner og en med tre elektroner fra 2s og 2p orbitaler.
- Som et andet eksempel vil et element som klor (1s2s2p3s3p) have tre orbitalskaller: en med to 1s elektroner, en med to 2s elektroner og seks 2p elektroner og en med to 3s elektroner og fem 3p elektroner.
Find antallet af elektroner i den yderste skal. Nu hvor du kender dit elements elektronskaller, er det nemt at finde valenselektroner: Brug bare antallet af elektroner i den yderste skal. Hvis den ydre skal er fuld (med andre ord, hvis den har otte elektroner eller for den første skal, to), er elementet inaktivt og reagerer ikke let med andre elementer. Igen følger tingene dog ikke helt disse regler for overgangsmetaller.
- For eksempel, hvis vi arbejder med Bor, da der er tre elektroner i den anden skal, kan vi sige, at Bor har tre valenselektroner.
Brug rækkerne i tabellen som genveje til orbitale skal. De vandrette rækker i det periodiske system kaldes elementet "perioder." Startende fra toppen af tabellen svarer hver periode til antallet af elektronskaller atomer i perioden besidder. Du kan bruge dette som en genvej til at bestemme, hvor mange valenselektroner et element har - start bare fra venstre side af sin periode, når du tæller elektroner. Endnu en gang vil du ignorere overgangsmetallerne med denne metode, som inkluderer gruppe 3-12.
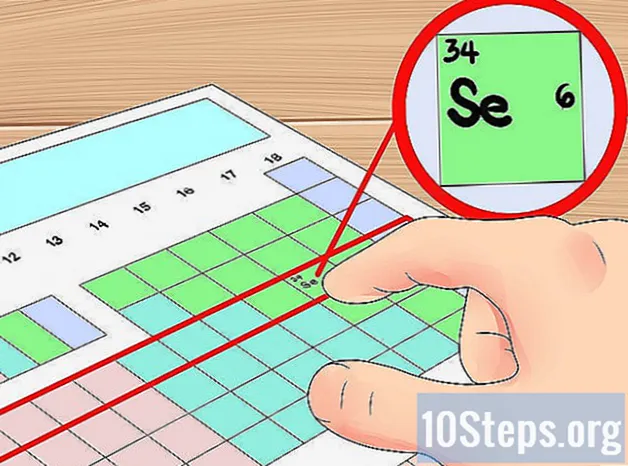
- For eksempel ved vi, at elementet selen har fire orbitalskaller, fordi det er i den fjerde periode. Da det er det sjette element fra venstre i den fjerde periode (ignorerer overgangsmetallerne), ved vi, at den ydre fjerde skal har seks elektroner, og således, at selen har seks valenselektroner.
Fællesskabs spørgsmål og svar
Hvordan beregner vi valenselektron?
Valenselektroner kan findes ved at bestemme de elektroniske konfigurationer af elementer. Derefter giver antallet af elektroner i den yderste skal det samlede antal valenselektroner i dette element.
Hvis et atom har 33 elektroner, hvor mange valenselektroner er der der?
Hvis atomet ikke er en ion, kan vi sige, at atomet har 33 protoner. Dette betyder, at det er element 33, som er arsen. Så ved vi, at det ikke er et overgangsmetal, så vi ser og finder, at enhedscifret for dets gruppenummer er 5, hvilket betyder, at det har 5 valenselektroner.
Hvordan bestemmer jeg atomnummeret for helium?
Antallet af protoner er lig med atomnummeret.
Hvorfor får elektronerne negativ ladning og ikke positiv ladning?
Atomer vinder eller mister elektroner, negative ladninger, fordi protonerne har den positive ladning, og de holdes i kernen af den stærke atomkraft. Dette er en af fire forskellige kræfter i universet: tyngdekraft, elektromagnetisme, den svage kraft og den stærke atomkraft. Det må være stærkt, fordi protoner frastøder hinanden, men de er virkelig tæt sammen i kernen (sammen med neutronerne, der også holdes af den stærke kraft.) Ideen er, at den stærke kraft er ekstremt stærk, men kun over meget små afstande. Tænk små superstærke kroge. For at få protoner og neutroner til at tilslutte sig, har du brug for kræfter som den enorme tyngdekraft af en stjerne, en supernova eller nuklear eksplosion.
Hvad er ædelgassens valanceelektron?
Ædelgasser har otte valenselektroner - den mest stabile tilstand for et element.
Hvorfor har nitrogen 6 valanceelektroner, men det er i gruppe 15?
Kvælstof har kun fem valanceelektroner, fordi det er i gruppe 5, selvom det faktisk er i gruppe 15, vil du ignorere overgangsmetallerne, fordi disse grupper har forskellige måder at bestemme deres valenselektroner på. Derfor: gruppe 13 betyder gruppe 3 så videre og så videre.
Et atom har 7 protoner, 8 neuroner og 7 elektroner. Hvad er antallet af elektroner i dens valensskal?
Elementet, der indeholder 7 protoner, er kvælstof. Kvælstof er i søjlen af elementer, der har 5 elektroner i valensskallen. Antallet af neutroner er irrelevant for at finde antallet af valenselektroner i et bestemt element.
Hvor på det periodiske system er atomerne med syv ydre skalelektroner placeret?
Se i den anden til sidste kolonne på højre side ved siden af de inaktive gasser.
Hvad er en valenselektron?
En valenselektron er en elektron, der findes i den yderste del af et atom og kan deles eller tages i en reaktion.
Hvorfor har elementer i det periodiske system forskellige antal valenselektroner?
De har forskellige kemiske strukturer. Valenselektroner skaber kemiske reaktioner.
Tips
- Bemærk, at elektronkonfigurationer kan skrives i en slags stenografi ved hjælp af ædle gasser (elementerne i gruppe 18) til at stå i orbitalerne i starten af konfigurationen. For eksempel kan natriums elektronkonfiguration skrives 3s1 - i det væsentlige er det det samme som neon, men med endnu en elektron i 3s-orbitalen.
- Overgangsmetaller kan have valensunderskaller, der ikke er fuldstændigt fyldte. Bestemmelse af det nøjagtige antal valenselektroner i overgangsmetaller involverer principper for kvanteteori, der ligger uden for denne artikels anvendelsesområde.
- Vær opmærksom på, at periodiske tabeller er forskellige fra land til land. Så tjek venligst, at du bruger den korrekte, opdaterede for at undgå forvirring.
- Sørg for at vide, hvornår du skal tilføje eller trække fra den sidste orbital for at finde valenselektroner.
Ting, du har brug for
- Periodisk systemelement
- Blyant
- Papir
Hver dag på wikiHow arbejder vi hårdt på at give dig adgang til instruktioner og information, der hjælper dig med at leve et bedre liv, uanset om det holder dig mere sikker, sundere eller forbedrer dit velbefindende. Midt i de nuværende folkesundhedsmæssige og økonomiske kriser, når verden skifter dramatisk, og vi alle lærer og tilpasser os ændringer i dagligdagen, har folk brug for wikiHow mere end nogensinde. Din support hjælper wikiHow med at skabe mere dybtgående illustrerede artikler og videoer og dele vores pålidelige mærke af instruktionsindhold med millioner af mennesker over hele verden. Overvej venligst at yde et bidrag til wikiHow i dag.