Indhold
Materiale kan ikke oprettes eller ødelægges i en kemisk reaktion i overensstemmelse med loven om bevarelse af masser, så de produkter, der kommer ud, skal svare til de reagenser, der var til stede i starten. Med andre ord skal den samme mængde af hvert indsat atom også komme ud. Støkiometri er en analyse af disse elementer og involverer beregninger, der overvejer masserne af reagenser og produkter i en given kemisk reaktion. Støkiometri involverer en lille smule matematik og en smule kemi, og er baseret på det enkelte princip ovenfor: den materie vindes eller tabes aldrig inden for en kemisk reaktion. Det første trin i løsning af ethvert kemisk problem er at afbalancere ligningen.
Steps
Metode 1 af 4: Balancering af den kemiske ligning

Skriv antallet af atomer i hver forbindelse på begge sider af ligningen. Gennem den kemiske ligning er det muligt at identificere mængden af atomer i hvert element i ligningen. Da det ikke er muligt at skabe eller ødelægge det deri indeholdte stof, vil ligningen være ubalanceret, hvis mængden (og typer) af atomer på hver side ikke er perfekt ækvivalente.- Glem ikke at multiplicere med en koefficient eller tegnet værdi, hvis relevant.
- For eksempel:
- På reagenssiden (til venstre) er der to hydrogenatomer, et svovlatom, fire oxygenatomer og et jernatom.
- På produktsiden (til højre) er der to hydrogenatomer, tre svovlatomer, oxygenatomer og to jernatomer.

Placer en koefficient foran de andre elementer end ilt og brint for at afbalancere begge sider. Identificer den fælles fælles minimumsfaktor blandt alle elementer undtagen ilt og brint for at opnå lige store mængder atomer på begge sider.- For eksempel er den mindst fælles fælles faktor mellem to og en to til . Placer en foran, på venstre side, for at afbalancere den.
- Den mindste fælles faktor mellem tre og en er tre til . Placer en foran for at skabe balance mellem begge sider.
- På det tidspunkt vil ligningen se sådan ud:

Balance ilt- og brintatomer. Disse to elementer er sidst afbalanceret, fordi de ofte forekommer i mange molekyler på begge sider af ligningen. Glem ikke at tælle atomerne igen på dette punkt i balancen, hvis du lægger koefficienter på molekylerne.- I eksemplet blev den ene placeret foran, og nu er der seks hydrogenatomer til venstre, med kun to på højre side af ligningen. Der er også oxygenatomer til venstre og oxygenatomer til højre, hvilket kan siges at være afbalanceret.
- Det er muligt at afbalancere hydrogener ved at tilføje en foran.
- Den endelige afbalancerede ligning skrives som følger:
Tæl antallet af atomer på hver side af ligningen igen for at sikre, at de er afbalancerede. Efter endt arbejde er det altid nyttigt at gå tilbage til begyndelsen og kontrollere ligningens balance. Dette kan gøres ved at tilføje alle atomer på begge sider af ligningen igen for at se, om værdierne stemmer overens.
- Bemærk ligningen i eksemplet:
- Til venstre for pilen er der seks hydrogenatomer, tre svovlatomer, oxygenatomer og to jernatomer.
- Til højre for pilen er der to jernatomer, tre svovlatomer, oxygenatomer og otte hydrogenatomer.
- Ligningens venstre og højre side kombineres, og det kan derfor siges, at de er afbalancerede.
Metode 2 af 4: Konvertering mellem gram og mol
Beregn Molar masse i gram af en forbindelse. Den molære masse repræsenterer mængden i gram () af en mol af den pågældende forbindelse. Det muliggør let konvertering mellem et stof og gram mol. For at beregne den molære masse skal du identificere, hvor mange molekyler af et bestemt element der er i forbindelsen, ud over atommassen for hver af dem.
- Definer antallet af atomer for hvert element i en given forbindelse. For eksempel udtrykkes glukose som, så der er seks carbonatomer, tolv hydrogenatomer og seks oxygenatomer.
- Identificer atommassen i gram pr. Mol () for hvert atom. Massen for hvert element er normalt peget under dets respektive symbol i den periodiske tabel, normalt i decimalværdi. Atommasserne af de elementer, der er til stede i glukose, er:
- Multiplicer den atomiske masse af hvert element med antallet af atomer i forbindelsen:
- Tilsætning af disse produkter resulterer i den molære masse af forbindelsen.
Massen på en mol glukose er lig med.
Konverter gram af et stof til mol gennem den molære masse. Ved at bruge den som en konverteringsfaktor er det muligt at beregne mængden af mol til stede i mængden af gram analyseret af en given forbindelse. Del den kendte mængde i gram () med den molære masse (). En simpel måde at vide, om den rigtige beregning blev foretaget, er at kontrollere, om enhederne annullerer hinanden og kun efterlader muldvarpene.
- For eksempel: hvor mange mol er der i gram hydrogenchlorid ()?
- Den atomære masse af brint er gram, og klorets masse er gram, så den molære masse af forbindelsen resulterer i.
- Opdeling af mængden i gram af stoffet med den molære masse resulterer i: mol af.
Bestemm det molære forhold mellem reagenserne. For at bestemme udbyttet af et produkt i en bestemt reaktion er det nødvendigt at bestemme det molære forhold. Den fortæller dig, hvilke stoffer der reagerer med andre, givet af koefficienten for de elementer, der er til stede i den afbalancerede ligning.
- For eksempel, hvad er molforholdet mellem og i den kemiske ligning?
- Først skal du observere, om ligningen er afbalanceret. Glem aldrig dette trin, ellers vil forholdene være forkerte. I dette tilfælde er der lige store dele af hvert element på begge sider, og derfor betragtes ligningen som afbalanceret.
- Forholdet på til er lig med. Det betyder ikke noget, hvilke værdier der forbliver i tælleren og nævneren, så længe de forbliver i samme position i løbet af problemet.
Kryds multiplicer med det molære forhold til bestemmelse af molerne i det andet reagens. For at beregne mængden af mol i et stof, der er produceret eller krævet i en bestemt reaktion, bruger du molforholdet.Problemer vil normalt bede dig om at bestemme den mængde mol, der kræves eller produceres i henhold til en bestemt mængde gram reagens.
- For eksempel, i betragtning af ligningen, hvor mange mol produceres med gram reagerende med en tilstrækkelig mængde af?
- I eksemplet repræsenterer denne tilstrækkelige mængde det, der er nødvendigt, så det er ikke vigtigt at overveje dets potentielle værdi for at løse problemet.
- Konverter først mængden i gram mol. Den atomære masse af nitrogen er lig med, så den molære masse af er lig med. Deling af massen med den molære masse resulterer i mol.
- Bestem de proportioner, der er givet af problemet:
- Kryds multiplicer forholdet med molforholdet med hensyn til, hvilket er:
Konverter mængden i mol tilbage til massen ved hjælp af stoffets molære masse. Du vil bruge den molære masse igen og nu med en multiplikation for at konvertere mol tilbage til gram. Husk at bruge den korrekte molære masse af stoffet.
- Molmassen på er lig med. Snart fra.
Metode 3 af 4: Konvertering mellem liter gas og mol
Bestem, om reaktionen finder sted under normale temperatur- og trykforhold (CNTP). Dette er det sæt betingelser, under hvilke en ideel mol gas optager liter () volumen. Standardtemperaturen er i dette tilfælde lig med Kelvin (), mens standardtrykket er ækvivalent med atmosfæren ().
- Generelt er en reaktion, der finder sted ved trykket på og ved temperaturen i, kun indikeret med forkortelsen CNTP.
Brug konverteringsfaktoren til at konvertere liter gas til mol. Hvis reaktionen sker på CNTP, kan du bruge værdien af til at beregne mængden af mol for et givet volumen gas. Del denne værdi i liter () med konverteringsfaktoren for at opnå det ønskede resultat.
- Konverter for eksempel liter gas til mol:
- Konverter for eksempel liter gas til mol:
Brug den ideelle gaslov til at konvertere liter gas, der ikke er under CNTP. Når du arbejder med en reaktion under forskellige forhold, bliver du nødt til at bruge Ideal Gas Law () til at bestemme mængden af mol der er til stede i en reaktion. repræsenterer trykket i atmosfæren, repræsenterer mængden af gassen i liter, repræsenterer mængden af mol af stoffet, repræsenterer gaskonstanten () og repræsenterer temperaturen i Kelvin.
- Ligningen kan omorganiseres for at bestemme mængden i mol:.
- Enhederne i gasskonstanten bruges til at annullere de andre variabler i ligningen.
- Bestem for eksempel mængden af mol der er til stede i liter a og. Når man indsætter variablerne i deres positioner, har vi det:
Metode 4 af 4: Konvertering mellem liter væsker og mol
Beregn massefylde af væsken. I nogle tilfælde giver kemiske ligninger mængden af en reagensvæske og beder om mængden af denne mængde i gram eller mol for at reaktionen skal finde sted. For at konvertere til gram skal der bruges densitet, en variabel, der består af massen divideret med volumen.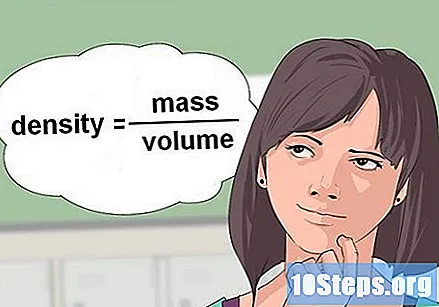
- Hvis tætheden ikke blev angivet i problemet, kan det være nødvendigt at kontrollere dets værdi i en referencetabel eller på internettet.
Konverter lydstyrken til milliliter (). For at konvertere væskens volumen til masse () skal du bruge værdien på dens densitet. Denne variabel er angivet i gram pr. Ml (), så væskens volumen skal være i milliliter for omdannelsen.
- Identificer den givne lydstyrke. Antag f.eks. Et problem, der indikerer, at du har en liter. For at konvertere denne værdi til skal du bare multiplicere den med, da der er milliliter i en liter vand.
Multiplicer lydstyrken med densiteten. Når du multiplicerer volumenet () med væskens () densitet, annulleres milliliterne, og du sidder med gram af det pågældende stof.
- For eksempel er densiteten af. Hvis den kemiske ligning siger, at du har, vil mængden i gram svare til.
Beregn Molar masse reagens. Det repræsenterer mængden i gram () af en mol af den forbindelse, der analyseres, foruden at du let kan konvertere mellem disse to enheder. For at beregne den molære masse skal du identificere, hvor mange molekyler af et givet element er i en bestemt forbindelse, ud over atommassen for hvert af de elementer, der findes i det.
- Definer antallet af atomer for hvert element, der er til stede i en forbindelse. I glukose () er der for eksempel seks carbonatomer, hydrogenatomer og seks oxygenatomer.
- Identificer atommassen i gram pr. Mol () for hvert atom. Atommasserne af hvert element, der er til stede i glukose, er:
- Identificer atommassen i gram pr. Mol () for hvert atom. Atommasserne af de elementer, der er til stede i glukose, er:
- Tilsætning af disse produkter resulterer i den molære masse af forbindelsen.
Massen på en mol glukose er lig med.
Konverter gram af et stof til mol ved hjælp af molmasse. Ved hjælp af det som en konverteringsfaktor kan du beregne mængden af mol der er til stede i den specificerede mængde gram stof. Del den kendte mængde i gram () med den molære masse (). En simpel måde at se, om beregningen blev foretaget korrekt, er at kontrollere, om enhederne blev annulleret, hvilket kun efterlader mol.
- For eksempel: hvor mange mol er der i hydrogenchlorid ()?
- Atommassen af é og é resulterer i massen af forbindelsen af.
- Opdelning af mængden i gram af stoffet med den molære masse resulterer i mol.