Indhold
Selvom alle atomer med det samme element indeholder det samme antal protoner, kan antallet af neutroner variere. At vide, hvor mange neutroner et bestemt atom har, kan hjælpe dig med at bestemme, om partiklen er regelmæssig i dette element eller en isotop, som vil have mere eller mindre neutroner. Det er ganske enkelt at bestemme antallet af neutroner i et atom og kræver intet eksperiment. For at beregne antallet af neutroner i et regulært atom eller isotop skal du følge disse instruktioner med en periodisk tabel i hånden.
Steps
Metode 1 af 2: Find antallet af neutraler i et fælles atom
Find elementet i den periodiske tabel. For dette eksempel, lad os se på OS (Os), som er i den sjette række, fra top til bund.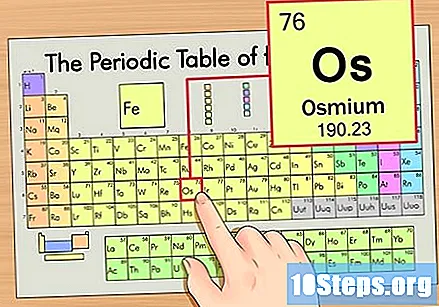
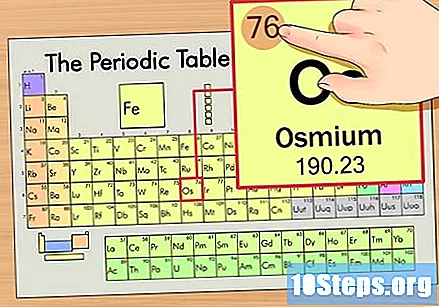
Find elementets atomnummer. Dette er normalt det mest synlige tal for et bestemt element og er normalt over dens symbol (i den tabel, vi bruger, er der faktisk ikke et andet nummer på listen). Atomnummeret er antallet af protoner i et enkelt atom i dette element. Antallet af Os er 76, hvilket betyder, at et Osmiumatom har 76 protoner.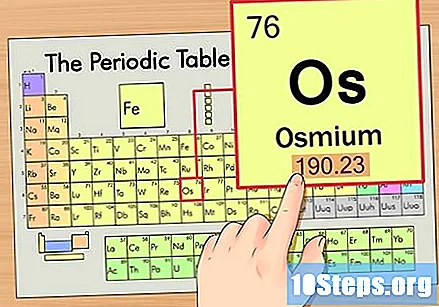
Find elementets atomvægt. Dette tal findes normalt under atomsymbolet. Bemærk, at tabellen i dette eksempel kun er baseret på atomnummeret og ikke angiver atomvægten. Dette vil ikke altid være tilfældet. Osmium har en atomvægt på 190,23.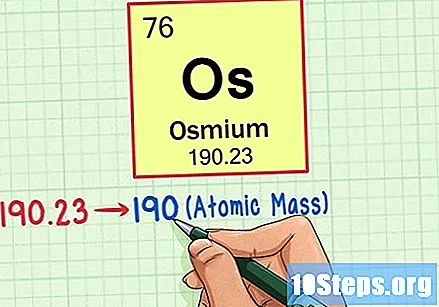
Rund atomvægten til det nærmeste hele tal for at finde atommassen. I vores eksempel ville 190.23 afrundes til 190, hvilket resulterede i en atommasse på 190 for Osmium.- Atommasse er et gennemsnit af elementets isotoper. Derfor er det normalt ikke et heltal.
Træk atomnummeret fra atommassen. Da langt de fleste af et atommasse findes i dets protoner og neutrale, vil det at trække antallet af protoner (dvs. atomnummeret) fra atommassen give dig antallet beregnet af neutroner i atomet. Tallet efter decimalpunktet repræsenterer generelt en meget lille masse af elektroner i atomet. I vores eksempel er dette: 190 (atommasse) - 76 (antal protoner) = 114 (antal neutroner).
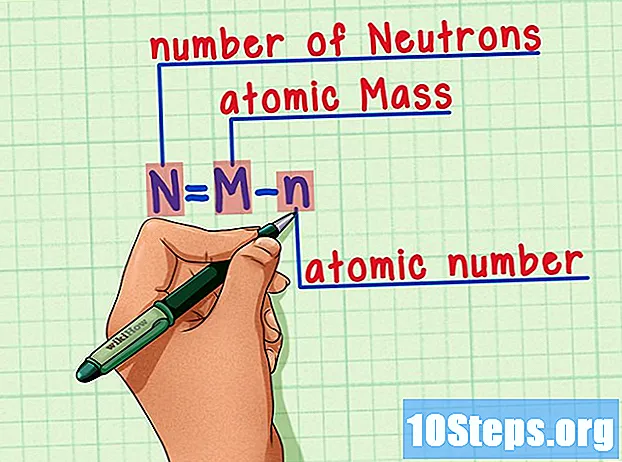
Husk formlen. For at finde antallet af neutroner i fremtiden skal du bare bruge denne formel: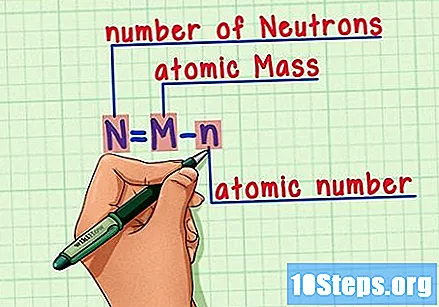
- N = M - n.
- N = antal af Neutrons.
- M = Matom stege.
- n = natomisk humerus.
- N = M - n.
Metode 2 af 2: Find antallet af neutroner i en isotop
Find elementet i den periodiske tabel. Lad os f.eks. Bruge carbon-14-isotopen. Da den ikke-isotopiske form for carbon-14 simpelthen er kul (C), skal du finde dette element i den periodiske tabel (i anden række).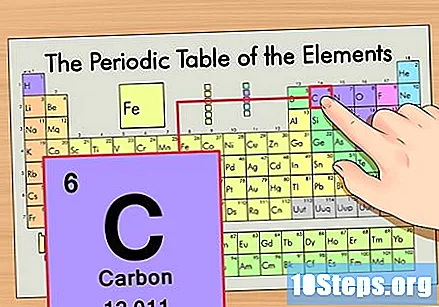
Find elementets atomnummer. Dette er normalt det mest synlige tal for et bestemt element og er normalt over dens symbol (i den tabel, vi bruger, er der faktisk ikke et andet nummer på listen). Atomnummeret er antallet af protoner i et enkelt atom i dette element. C er nummer 6, hvilket betyder, at et carbonatom har 6 protoner.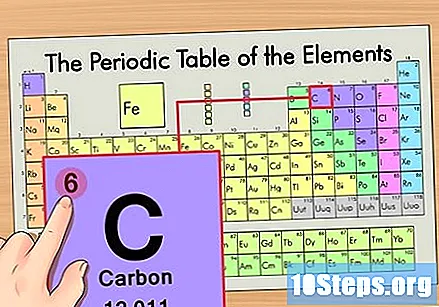
Find atommassen. Dette er utroligt let med isotoper, da de er opkaldt efter deres atommasse. Carbon-14 har en atommasse på 14. Når du først har fundet atommassen i isotopen, er processen til at finde antallet af neutroner den samme som den, der bruges til almindelige atomer.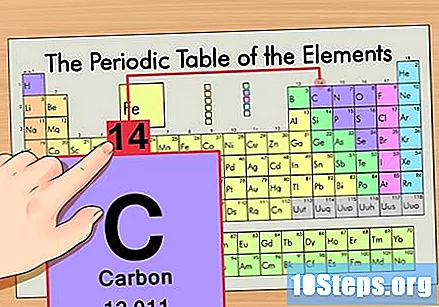
Træk atomnummeret fra atommassen. Da langt de fleste af et atommasse findes i dets protoner og neutrale, vil det at trække antallet af protoner (dvs. atomnummeret) fra atommassen give dig antallet beregnet af neutroner i atomet. Tallet efter decimalpunktet repræsenterer generelt en meget lille masse af elektroner i atomet. I vores eksempel er dette: 14 (atommasse) - 6 (antal protoner) = 8 (antal neutroner).
Husk formlen. For at finde antallet af neutroner i fremtiden skal du bare bruge denne formel: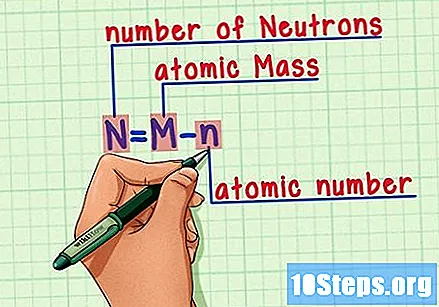
- N = M - n.
- N = antal af Neutrons.
- M = Matom stege.
- n = natomisk humerus.
- N = M - n.
Tips
- Osmium, et fast metal ved stuetemperatur, henter sit navn fra det græske ord for 'lugt', 'osme'.
- Protoner og neutroner udgør næsten hele elementernes vægt, mens elektroner og andre forskellige partikler repræsenterer en ubetydelig masse (nærmer sig nul masse). Da en proton er omtrent den samme vægt som en neutral, og atomnummeret repræsenterer antallet af protoner, kan vi ganske enkelt trække antallet af protoner fra den samlede masse.
- Hvis du ikke er sikker på, hvilket antal der er i det periodiske system, skal du bare huske, at det normalt laves omkring atomnummeret (det vil sige antallet af protoner), der starter med 1 (Hydrogen) og går op en enhed pr. fra venstre til højre, slutter i 118 (Ununóctio). Dette skyldes, at antallet af protoner i et atom bestemmer, hvad dette atom er, hvilket gør det lettere at organisere elementkarakteristikken (for eksempel vil et atom med 2 protoner altid være Helium, ligesom et andet atom med 79 protoner altid vil være Guld).


